|
|
CURSO DE BIOLOGÍAAlejandro Porto Andión |
|
|
|
|
|
|
|
Inicio Temas de Células Aula virtual |
|
|
|
|
TEMA 16: EL CATABOLISMO.
Entre los distintos tipos de biomoléculas orgánicas que forman parte de las células vivas hay que distinguir por un lado a las proteínas y los ácidos nucleicos, cuya misión fundamental es el almacenamiento, transmisión y expresión de la información genética ("biomoléculas informativas"), y por otro a los glúcidos y lípidos ("biomoléculas energéticas") cuya principal misión es la de proporcionar energía para los distintos procesos celulares y que por lo tanto están llamados a ser los grandes protagonistas del catabolismo. De todos modos, dado que las células se encuentran en un continuo proceso de renovación de sus componentes moleculares, el catabolismo comprende rutas que permiten llevar a cabo la degradación de todas y cada una de las biomoléculas. En este capítulo analizaremos las distintas rutas catabólicas con especial incidencia en aquellas responsables de la degradación de glúcidos y lípidos, por ser éstas las que más frecuentemente utilizan las células.
1.-CATABOLISMO DE AZUCARES.
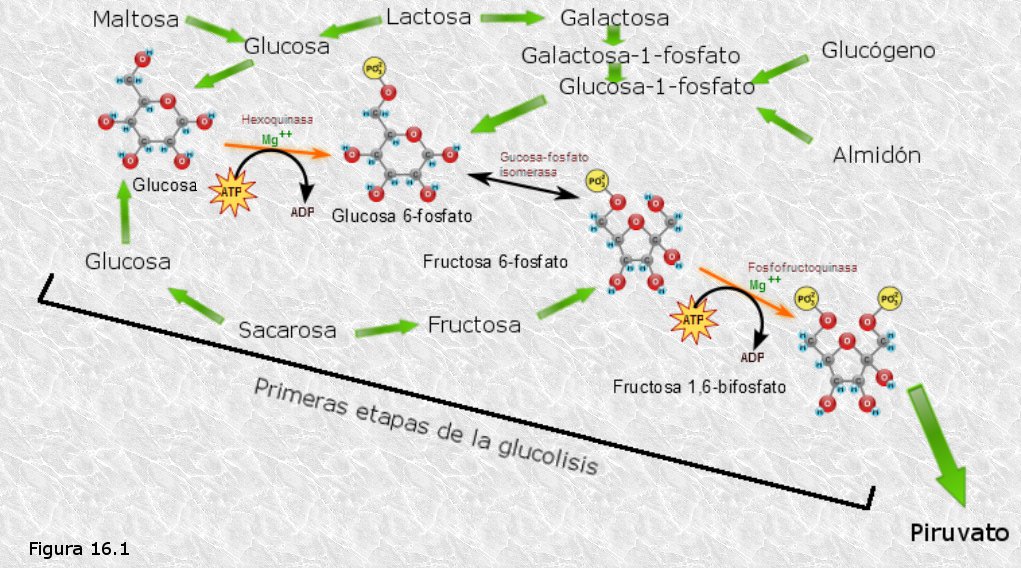
Por ser la glucosa el monosacárido más abundante en la naturaleza, la degradación de los azúcares se lleva a cabo "vía glucosa". Así, el catabolismo de los azúcares converge hacia una única ruta central de degradación de la glucosa.
Los grandes polisacáridos de reserva, mediante una reacción de fosforilación catalizada por la glucógeno-fosforilasa o por la almidón fosforilasa según se trate de glucógeno o de almidón, liberan unidades de glucosa-1-fosfato, que a continuación, por acción de la fosfoglucomutasa se transforma en glucosa-6-fosfato, la cual es el primer intermediario de la ruta de degradación de la glucosa (Figura 16.1).
Los monosacáridos diferentes de la glucosa, que en ocasiones pueden proceder de la hidrólisis de distintos tipos de oligosacáridos, se transforman en glucosa o en algunos de los intermediarios de su degradación, mediante reacciones de isomerización.
Una vez transformados en glucosa los azúcares se pueden degradar completamente hasta CO2 Y H2O siguiendo un camino que incluye tres rutas metabólicas principales: Glucolisis, Ciclo de Krebs y Cadena respiratoria. Existe además una ruta alternativa, la Ruta de las pentosas.
1.1.-GLUCOLISIS (RUTA EMBDEN-MEYERHOF).
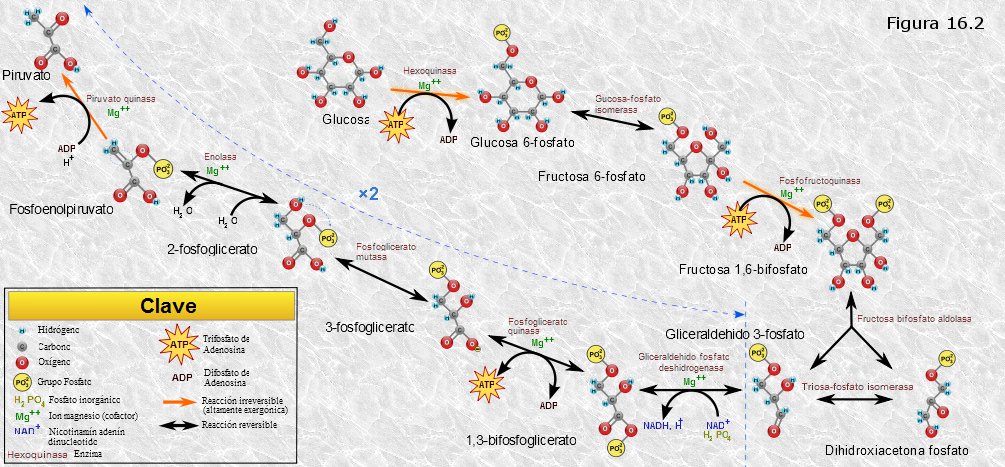
Es un conjunto de reacciones consecutivas que degradan la glucosa (6 at. de carbono), transformándola en dos moléculas de ácido pirúvico (3 at. de C). Estas reacciones son anaerobias, es decir, no participa en ellas el oxígeno, y transcurren íntegramente en el hialoplasma celular. Concomitantemente parte de la energía química de la glucosa es recuperada en forma de ATP y NADH.
Probablemente la glucolisis haya sido, en el curso de la evolución biológica, la primera ruta metabólica de la que las células dispusieron para obtener energía. También fue la primera ruta que los bioquímicos conocieron en su totalidad.
Las 10 etapas de la glucolisis se detallan en el esquema de la Figura 16.2. Podemos agrupar estas 10 reacciones en dos fases bien diferenciadas:
1.- La glucosa se degrada para dar lugar a dos moléculas de gliceraldehido-3-fosfato. Para ello hace falta energía que es aportada por dos moléculas de ATP.
2.- Las dos moléculas de gliceraldehido-3-fosfato se transforman en dos moléculas de ácido pirúvico. La energía liberada en este proceso es recuperada en forma de cuatro moléculas de ATP y dos de NADH. Es fundamentalmente la oxidación del gliceraldehido-3-fosfato en la reacción 6 la que libera la energía química, que se recupera en parte en forma de NADH y en parte, mediante dos fosforilaciones a nivel de sustrato en las reacciones siguientes, en forma de ATP.
Así pues, la glucolisis parece necesitar de una primera fase de "cebado", en la cual se consume energía del ATP, para que la energía química de la glucosa pueda ser liberada en la segunda fase obteniéndose una cantidad mayor de ATP y también NADH.
Haciendo un balance de lo ocurrido durante la glucolisis, por cada molécula de glucosa degradada se obtienen 2 moléculas de ácido pirúvico, 2 moléculas de NADH y 2 moléculas de ATP (4 obtenidas en la segunda fase menos 2 consumidas en la primera).
El rendimiento energético en moléculas de ATP de la degradación de la glucosa a ácido pirúvico a través de la glucolisis no es muy elevado. La glucosa contiene en sus enlaces mucha más energía química que la que pudo ser recuperada hasta ahora en forma de 2 moléculas de ATP. Parte de esa energía se habrá perdido en forma de calor en el transcurso de la glucolisis, pero otra parte importante permanece en los enlaces del ácido pirúvico y en el NADH, y sólo podrá ser extraída mediante la oxidación de estos compuestos en las reacciones aerobias de la respiración celular que tienen lugar en la mitocondria, en las cuales se producirá una cantidad mucho mayor de ATP.
Sin embargo, algunas formas de vida muy simples, tales como algunas bacterias y levaduras, pueden sobrevivir holgadamente con esta pequeña cantidad de energía que obtienen de la glucolisis, debiendo resolver entonces algunos problemas que analizaremos a continuación.
1.2.-FERMENTACIONES.
Por cada molécula de glucosa que se degrada en la glucolisis 2 moléculas de NAD+ se transforman en NADH. Puesto que la cantidad de NAD+ que poseen las células es limitada debe existir algún mecanismo que permita oxidar el NADH transformándolo de nuevo en NAD+ para que pueda ser reutilizado en la glucolisis, de lo contrario todo el proceso se detendría.
En las células aerobias el NADH se oxida a NAD+ cediendo sus electrones al oxígeno (aceptor último de electrones en este tipo de células) a través de la cadena de transporte electrónico mitocondrial.
En las células anaerobias, que no pueden utilizar el oxígeno como aceptor último de electrones en sus oxidaciones metabólicas, el NADH se oxida a NAD+ cediendo sus electrones a una molécula orgánica aceptora, que puede ser el ácido pirúvico o algún producto de la transformación de éste, a través de una o más reacciones adicionales a la glucolisis. Estas etapas adicionales que tienen como único objeto reciclar el NADH obtenido en la glucolisis a NAD+ reciben el nombre de fermentaciones.
Las fermentaciones consisten, pues, en la transformación del ácido pirúvico que se obtiene al final de la glucolisis, en algún otro producto orgánico sencillo que es diferente en cada tipo de fermentación. Existen muchos tipos de fermentación que dan lugar a toda una gama de productos, algunos de ellos de interés alimentario o industrial, pero los dos tipos principales son la fermentación homoláctica y la fermentación alcohólica.
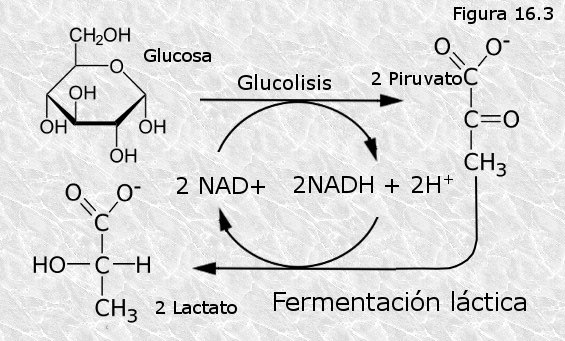
a) Fermentación homoláctica.- Tiene lugar en una sola etapa: el ácido pirúvico acepta un par de electrones procedente del NADH con lo cual se reduce a ácido láctico, que es el producto final (Figura 16.3).
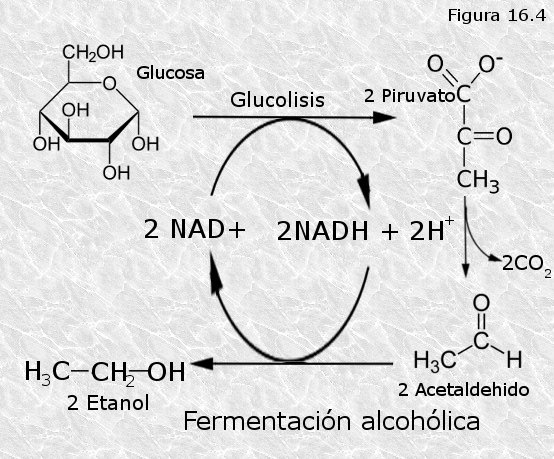
b) Fermentación alcohólica.- Tiene lugar en dos etapas. En la primera el ácido pirúvico pierde su grupo carboxilo en forma de CO2 para dar acetaldehido. En la segunda el acetaldehido acepta un par de electrones procedentes del NADH transformándose en alcohol etílico. Alcohol etílico y CO2 son los productos finales (Figura 16.4).
La fermentación heteroláctica es un tipo mixto en el que se obtiene una molécula de ácido láctico, una de alcohol etílico y una de CO2.
Existen células, llamadas anaerobias estrictas, que en ningún caso pueden utilizar el oxígeno como aceptor de electrones. En ellas la glucolisis, complementada por algún tipo de fermentación, es la única ruta disponible para la obtención de energía. Dado que cuando la vida se originó sobre la Tierra la atmósfera carecía de oxígeno, es de suponer que las primeras células vivas pertenecían a esta categoría. Prueba de ello es que la mayoría de las células actuales, incluidas las aerobias, conservan la capacidad de fermentar el ácido pirúvico a ácido láctico y la utilizan durante cortos períodos en los que el oxígeno no está disponible, obteniendo entonces energía exclusivamente a partir de la glucolisis. Así ocurre en las células del músculo esquelético, que aunque normalmente trabajan en condiciones aerobias, pueden obtener energía por este procedimiento en ocasiones, como por ejemplo durante un ejercicio muscular intenso, en las que el oxígeno aportado por la sangre resulta insuficiente. En la actualidad es práctica habitual en algunos deportes de alta competición medir de manera periódica durante los entrenamientos los niveles de ácido láctico en sangre de los deportistas, con el objeto de determinar en cada caso el umbral de esfuerzo a partir del cual el músculo comienza a trabajar en anaerobiosis y, en consecuencia, a disminuir su rendimiento.
1.3.-RUTA DE LAS PENTOSAS (RUTA DEL FOSFOGLUCONATO).
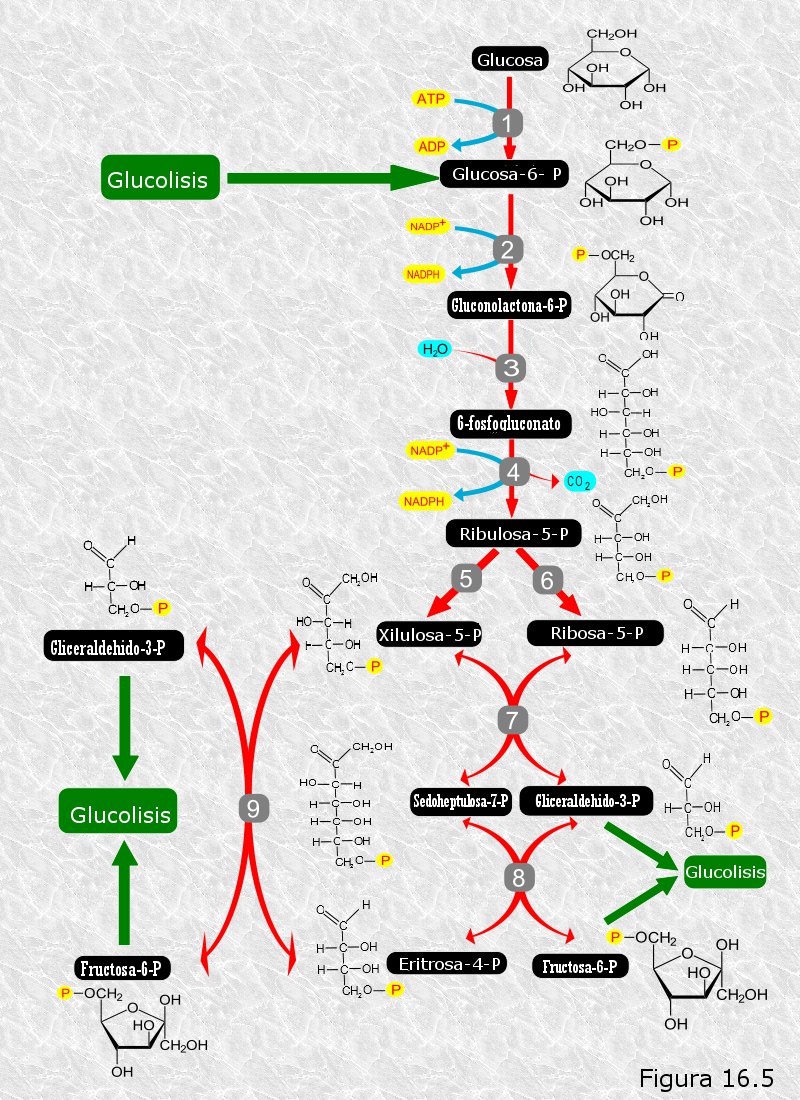
La glucolisis tiene como misión recuperar parte de la energía química de la glucosa en forma de ATP. Sin embargo, las células pueden necesitar en ocasiones degradar la glucosa con otros fines.
La ruta de las pentosas (Figura 16.5) es una vía alternativa a la glucolisis que tiene como finalidad la obtención de azúcares de 5 átomos de carbono, como la ribosa, necesarios para la biosíntesis de nucleótidos, y de coenzima reducido NADPH necesario para diversos tipos de biosíntesis en el anabolismo (particularmente para la biosíntesis reductora de ácidos grasos).
En la ruta de las pentosas la glucosa-6-fosfato da lugar, mediante dos deshidrogenaciones y una descarboxilación en las que se obtiene NADPH, a una molécula de CO2 y a un azúcar de 5 átomos de carbono, la ribulosa-5-fosfato, que después se transforma en ribosa-5-fosfato.
Dado que los productos de esta ruta se emplean en procesos biosintéticos del anabolismo, podemos considerar que la ruta de las pentosas es una ruta típicamente anfibólica.
1.4.-OXIDACIONES RESPIRATORIAS.
Las células aerobias pueden oxidar el ácido pirúvico obtenido en la glucolisis en presencia de oxígeno molecular y obtener así una gran cantidad de energía en forma de ATP. El proceso completo de degradación de la glucosa en presencia de oxígeno se conoce como respiración celular.
Desde los tiempos del químico Lavoisier es sabido que el proceso respiratorio consiste en una reacción de la materia orgánica con el oxígeno para dar como productos dióxido de carbono y agua. Esta reacción es similar a la que se produce en la combustión de cualquier tipo de materia orgánica. Se suele decir que las oxidaciones respiratorias son combustiones a baja temperatura o "combustiones sin llama". El proceso de oxidación de la materia orgánica en presencia de oxígeno es fuertemente exergónico y parte de la energía química que en él se libera es recuperada en forma de ATP. La ecuación global de la respiración celular puede escribirse como sigue:
MATERIA ORGÁNICA + O2 → CO2 + H2O
Las reacciones aerobias de la respiración celular tienen lugar íntegramente en la mitocondria, más concretamente en la matriz mitocondrial y en la membrana mitocondrial interna. Veremos más adelante que estas oxidaciones respiratorias no son exclusivas del catabolismo de los azúcares, sino que en gran medida son comunes al catabolismo de otras biomoléculas como lípidos y proteínas. Sin embargo, vamos a centrarnos ahora en los procesos que conducen a la degradación total hasta CO2 y H2O del ácido pirúvico procedente de la glucolisis, a saber, la descarboxilación oxidativa del ácido pirúvico, el ciclo de Krebs, y la cadena respiratoria.
1.4.1.-DESCARBOXILACIÓN OXIDATIVA DEL ÁCIDO PIRÚVICO.
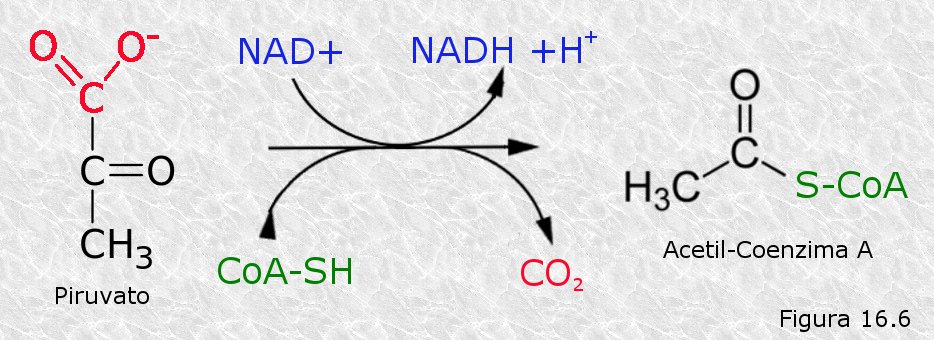
El ácido pirúvico procedente de la glucolisis penetra en la matriz mitocondrial a través de permeasas específicas de las membranas mitocondriales. Una vez allí, sufre una descarboxilación oxidativa catalizada por el complejo de la piruvato deshidrogenasa, dando lugar a una molécula de CO2 y a un grupo acetilo del acetil-coenzima A (Figura 16.6). Por cada molécula de ácido pirúvico se consume una de coenzima A (un coenzima transportador de grupos acilo) y una molécula de NAD+ es reducida a NADH. Hay que destacar que, dado que cada molécula de glucosa da lugar a dos de ácido pirúvico en la glucolisis, y que en la descarboxilación de cada una de éstas se desprende una molécula de CO2, dos de los seis átomos de carbono de la glucosa se han desprendido ya en forma de estas dos moléculas de CO2, que es uno de los productos finales de la respiración celular.
1.4.2.- CICLO DE KREBS.
El acetil-CoA obtenido en la etapa anterior puede ser ahora oxidado en la misma matriz mitocondrial mediante una ruta metabólica cíclica llamada ciclo de los ácidos tricarboxílicos o ciclo del ácido cítrico, y que, en honor a su descubridor, es más conocida por ciclo de Krebs.
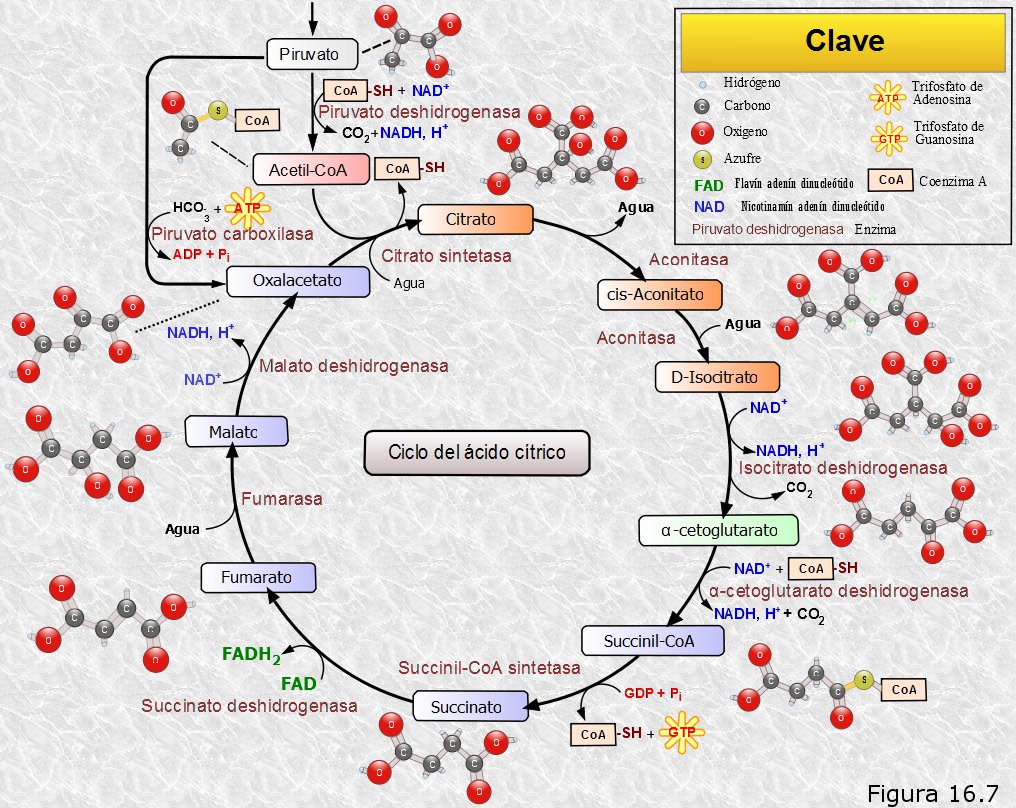
El ciclo se inicia con la condensación del grupo acetilo del acetil-CoA (2C) con una molécula ácido oxalacético (4C) para dar un ácido tricarboxílico de 6 átomos de carbono, el ácido cítrico. En esta reacción se libera el coenzima A. Posteriormente, en una secuencia de siete reacciones catalizadas enzimáticamente, se eliminan dos átomos de carbono en forma de CO2 y se regenera el ácido oxalacético. Las distintas etapas del ciclo se encuentran detalladas en el esquema de la Figura 16.7.
A lo largo del ciclo se producen dos descarboxilaciones oxidativas, en las etapas 3 y 4, que liberan dos moléculas de CO2. Con ello se completa la degradación del esqueleto carbonado de la glucosa: dos átomos de carbono se desprendieron en forma de dos moléculas de CO2 en la descarboxilación oxidativa de dos moléculas de ácido pirúvico; las dos moléculas de acetil-CoA resultantes ingresan en el ciclo de Krebs liberándose por cada una de ellas otras dos moléculas de CO2; en total se han liberado seis moléculas de CO2 que se corresponden con los seis átomos de carbono de la glucosa.
Por otra parte, las distintas oxidaciones que tienen lugar a lo largo del ciclo liberan electrones, que en unos casos son captados por el NAD+ (reacciones 3, 4 y 8) y en otros por el FAD (reacción 6), los cuales se reducen respectivamente a NADH y FADH2.
Además, en la reacción 5, tiene lugar una fosforilación a nivel de sustrato, consecuencia de la anterior oxidación, que da lugar a una molécula de GTP, posteriormente transformable en ATP.
Haciendo un balance de lo ocurrido en el ciclo de Krebs, por cada grupo acetilo del acetil-CoA que ingresa en el mismo se obtienen 2 moléculas de CO2, 3 moléculas de NADH, 1 molécula de FADH2 y una molécula de GTP transformable en ATP.
El rendimiento energético en moléculas de ATP obtenido hasta el momento no parece muy alto: sólo dos moléculas de ATP en la glucolisis y otras dos en el ciclo de Krebs (una por cada acetil-CoA). Sin embargo, una gran parte de la energía química de la glucosa está temporalmente retenida en forma de "electrones de alta energía" de los coenzimas reducidos NADH y FADH2 que se fueron obteniendo a lo largo de todo el proceso. Será en la siguiente etapa de las oxidaciones respiratorias cuando estos coenzimas cedan sus electrones al oxígeno, produciéndose así, por fin, la liberación de toda esa energía, una parte de la cual será recuperada en forma de ATP.
1.4.3.- CADENA RESPIRATORIA.
Los electrones de los coenzimas reducidos NADH y FADH2 procedentes de las anteriores etapas del catabolismo de los azúcares pueden ser ahora cedidos a una de los varios miles de cadenas de transportadores de electrones que se encuentran distribuidas por toda la superficie de la membrana mitocondrial interna y que reciben el nombre de cadenas respiratorias. Estas cadenas conducen los electrones hasta el oxígeno, el aceptor último, que se reduce para formar H2O, el otro producto final de la degradación de la glucosa.
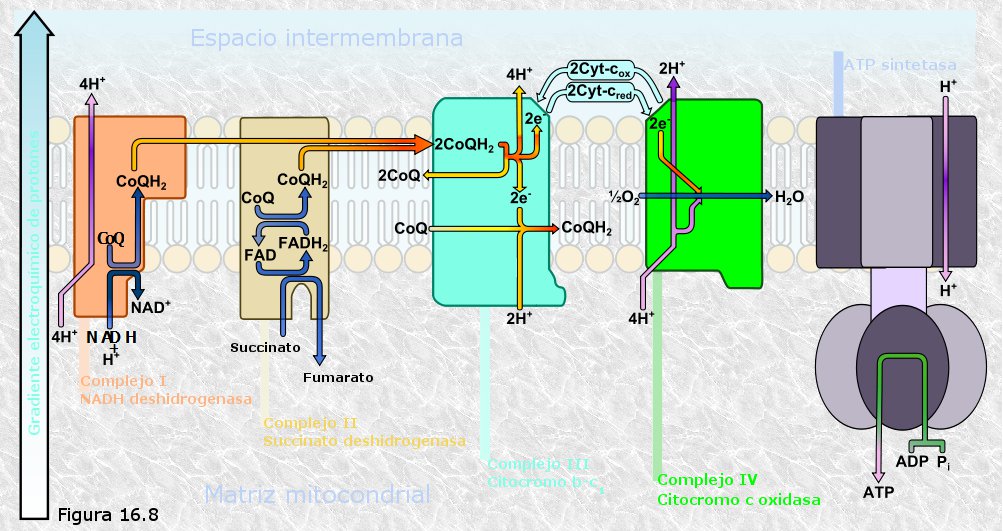
Cada cadena respiratoria está constituida por unas 15 moléculas transportadoras agrupadas en 4 complejos principales (Figura 16.8). Estos transportadores son proteínas y coenzimas cuya estructura química les permite aceptar o ceder electrones de modo reversible.
El transporte de electrones se realiza mediante una serie de reacciones redox en cada una de las cuales intervienen dos transportadores: uno de ellos se oxida cediendo un par de electrones al otro, que se reduce. Los transportadores no se encuentran distribuidos al azar dentro de la cadena sino que se encuentran ordenados de menor a mayor potencial redox. El potencial redox es una medida de la afinidad que tienen los transportadores por los electrones: la afinidad es mayor cuanto mayor es el potencial redox.
La disposición ordenada y fija de los constituyentes de la cadena respiratoria hace que el transporte de electrones se realice a favor de gradiente de potencial redox, es decir, desde buenos dadores de electrones (potencial redox bajo) a buenos aceptores (potencial redox alto). Este transporte a favor de diferencia de potencial redox, que podríamos calificar de "cuesta abajo", es un proceso fuertemente exergónico en el que se desprende una gran cantidad de energía química.
Los electrones procedentes del NADH son cedidos al complejo I, que se encuentra al principio de la cadena, mientras que los que proceden del FADH2 son cedidos al coenzima Q, que se encuentra entre los complejos I y II, por lo que éstos últimos no recorren toda la cadena. En ambos casos son transportados hasta el O2, que de todos los constituyentes de la cadena es el que tiene mayor potencial redox.
Hay que tener en cuenta que, si bien los coenzimas reducidos obtenidos en las rutas catabólicas que tienen lugar en la matriz pueden ceder sus electrones directamente a la cadena respiratoria, no ocurre lo mismo con los que se obtienen en el hialoplasma (el NADH obtenido en la glucolisis), ya que estos coenzimas no pueden atravesar las membranas mitocondriales. De todos modos, el poder reductor generado en el hialoplasma es transferido a la cadena respiratoria a través de sistemas de lanzadera altamente especializados en los que concurren diversos coenzimas transportadores de electrones.
Con la llegada de los electrones al oxígeno, que se reduce entonces para formar agua, se completa el proceso de degradación de la glucosa a CO2 y H2O.
1.4.4.- FOSFORILACIÓN OXIDATIVA.
En el transporte de electrones a favor de diferencia de potencial redox que se lleva a cabo en la cadena respiratoria se produce un importante desprendimiento de energía. La célula recupera parte de esa energía en forma de ATP mediante un proceso de fosforilación acoplada al transporte electrónico que, en este caso, recibe el nombre de fosforilación oxidativa.
El mecanismo que acopla el transporte electrónico mitocondrial con la fosforilación oxidativa es uno de los ejemplos más patentes de la gran capacidad de las células para manipular eficazmente la energía. Se conoce con el nombre de acoplamiento quimiosmótico de la fosforilación oxidativa y será analizado en detalle en los siguientes párrafos.
El átomo de hidrógeno puede disociarse fácilmente dando lugar a un protón y un electrón, y éstos pueden asociarse de nuevo para reconstituir al átomo de hidrógeno. En la cadena respiratoria los electrones pueden viajar en forma de tales electrones o bien, asociados a los correspondientes protones, en forma de átomos de hidrógeno. Existen transportadores de electrones y transportadores de hidrógeno intercalados a lo largo de toda la cadena. Cuando un transportador de hidrógeno oxida a un transportador de electrones debe captar de su entorno 2 protones para, junto con los dos electrones que acepta, formar dos átomos de hidrógeno. Cuando por el contrario un transportador de electrones oxida a un transportador de hidrógeno acepta de éste sólo los dos electrones y libera los dos protones que llevan asociados. Este hecho no tendría mayores consecuencias si no fuera porque los transportadores están dispuestos en la membrana mitocondrial interna de manera que cuando un transportador requiere protones los toma siempre del lado de la membrana que da a la matriz, mientras que cuando un transportador libera protones lo hace siempre del lado de la membrana que da al espacio intermembrana. El resultado de todo ello es que, a medida que los electrones circulan por la cadena respiratoria se produce un bombeo de protones a través de la membrana mitocondrial (ver Figura 16.8). Este bombeo genera un gradiente electroquímico de protones entre la matriz y el espacio intermembrana: la concentración de protones se va haciendo mayor en el espacio intermembrana y menor en la matriz. De este modo, el acoplamiento entre un proceso químico, el transporte de electrones, y otro osmótico, el bombeo de protones, se utiliza para recuperar la energía desprendida en el primero de ellos en forma de un gradiente electroquímico "rico en energía".
A lo largo de la cadena respiratoria existen tres centros de bombeo de protones, de manera que por cada par de electrones procedentes del NADH que recorre la cadena se bombean 6 protones (2 en cada centro de bombeo) desde la matriz al espacio intermembrana. Los electrones procedentes del FADH2, al entrar en la cadena en un punto intermedio de ésta, eluden el primer centro de bombeo, con lo que cada par de electrones procedentes de este coenzima bombea sólo 4 protones.
La energía acumulada en forma de gradiente electroquimico de protones se utiliza a continuación para impulsar un proceso endergónico que es la fosforilación de ADP a ATP. Esta reacción es catalizada por un enzima, la ATP-sintetasa, ubicada en la membrana mitocondrial interna. Los protones acumulados en el espacio intermembrana tienden a regresar a la matriz atravesando la membrana a favor de gradiente electroquímico, pero la membrana es relativamente impermeable al paso de los iones, por lo que este regreso sólo puede realizarse a través de la ATP-sintetasa (ver Figura 16.8). Es precisamente el regreso de los protones a favor de gradiente electroquímico a través de la ATP-sintetasa lo que libera la energía necesaria para impulsar la fosforilación del ADP a ATP.
Se ha comprobado que el regreso a la matriz de dos protones a través de la ATP-sintetasa libera energía suficiente para obtener una molécula de ATP. Por lo tanto, por cada par de electrones que atraviesan la cadena respiratoria procedentes del NADH se obtendrán 3 moléculas de ATP, mientras que por cada par de electrones procedentes del FADH2 se obtendrán sólo 2 moléculas de ATP.
1.5.-BALANCE DE LA OXIDACIÓN DE LA GLUCOSA.
Podemos reunir ahora toda la información acerca de las distintas rutas metabólicas implicadas en la degradación total de la glucosa hasta dióxido de carbono y agua y hacer un balance energético de la misma, es decir, averiguar cuántas moléculas de ATP se han obtenido y qué porcentaje de la energía química de la glucosa ha sido recuperada en forma de enlaces fosfato de alta energía. Un sencillo cálculo (que puedes realizar como ejercicio) nos indica que se obtienen 38 moléculas de ATP por cada molécula de glucosa degradada completamente hasta CO2 y H2O, lo que supone que aproximadamente un 40% de la energía química de la glucosa se ha recuperado en forma de ATP. El resto se ha desprendido en forma de calor y constituye el precio que deben pagar las células por mantenerse alejadas del equilibrio termodinámico.
2.-CATABOLISMO DE LÍPIDOS.
Dado que los lípidos que con más frecuencia degradan las células para obtener energía son los triacilglicéridos o grasas neutras, analizaremos sus rutas degradativas como modelo del catabolismo de los lípidos en general. Recordaremos que los triacilglicéridos son ésteres de la glicerina con tres ácidos grasos.
La primera etapa de la degradación de los triacilglicéridos consiste en la hidrólisis de los tres enlaces éster que poseen para dar lugar a la glicerina y los ácidos grasos libres. Esta reacción de hidrólisis está catalizada por unos enzimas llamados lipasas y tiene lugar en el hialoplasma celular. A continuación la glicerina y los ácidos grasos siguen rutas degradativas separadas.
2.1.-DEGRADACIÓN DE LA GLICERINA.
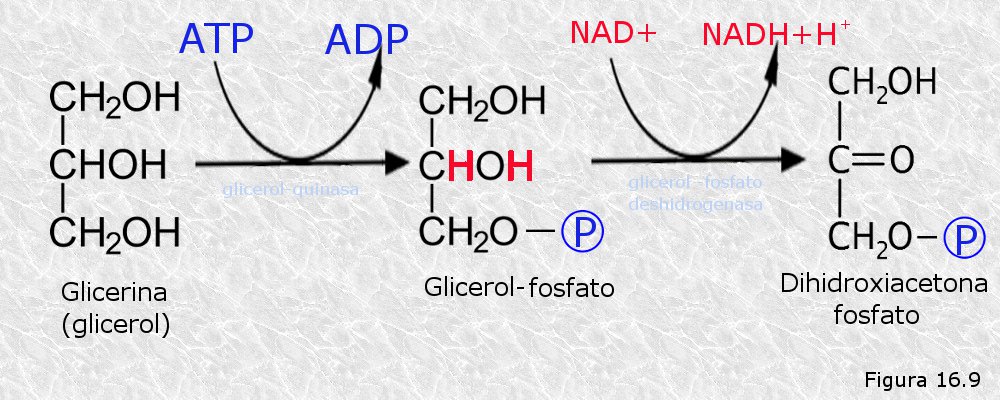
La glicerina procedente de la hidrólisis de las grasas se fosforila a expensas de una molécula de ATP para dar lugar a glicerol-fosfato, el cual se oxida a continuación, cediendo sus electrones al NAD+ para transformarse en dihidroxiacetona-fosfato (Figura 16.9). Este último compuesto se degrada a través de la glucolisis, de la que es uno de sus intermediarios. Así, vemos que la ruta de degradación de la glicerina converge con las rutas del catabolismo de los azúcares. Por otra parte, el NADH obtenido así en el hialoplasma, cede sus electrones a los sistemas de lanzadera que los conducirán a la cadena de transporte electrónico mitocondrial para producir ATP.
2.2.-DEGRADACIÓN DE LOS ÁCIDOS GRASOS: LA ß-OXIDACIÓN.
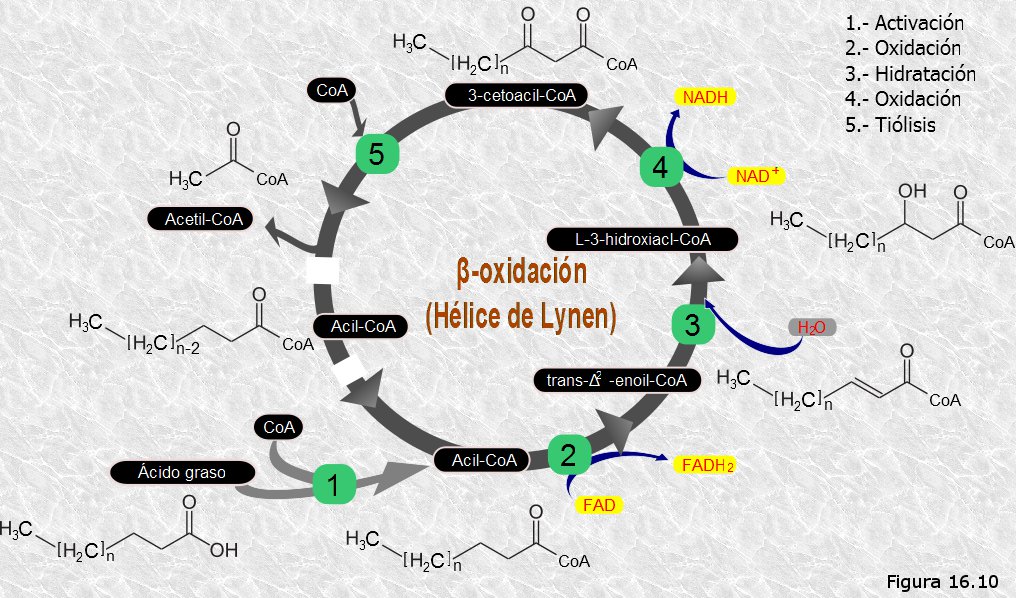
Los ácidos grasos, una vez liberados en el hialoplasma, penetran en la matriz mitocondrial y son allí degradados a acetil-CoA mediante una ruta catabólica llamada ß-oxidación de los ácidos grasos o hélice de Lynen. Para ello deben ser previamente activados por una molécula de coenzima A transformándose en acil(graso)-CoA. Esta activación tiene lugar cuando el ácido graso atraviesa la membrana mitocondrial externa y requiere el consumo de una molécula de ATP que se hidroliza para dar AMP y pirofosfato. El pirofosfato se hidroliza seguidamente para dar dos moléculas de fosfato inorgánico, con lo que, en realidad, se consumen dos enlaces fosfato de elevada energía.
La ß-oxidación consiste en una secuencia de cuatro reacciones, dos de las cuales son oxidaciones que afectan al carbono de la posición ß del ácido graso (Figura 16.10). Los electrones liberados en estas dos oxidaciones son recuperados en forma de una molécula de NADH y otra de FADH2. La consecuencia última de estas oxidaciones es la rotura del enlace que une los carbonos α y ß del ácido graso, lo que conlleva la liberación de los dos átomos de carbono terminales en forma de acetil-CoA. Al mismo tiempo, el carbono ß, ahora oxidado a grupo carboxilo, se une a una nueva molécula de CoA, esta vez sin consumo de ATP, dando lugar a un nuevo ácido graso activado con 2 átomos de carbono menos que el original. Este ácido graso activado puede entrar ahora en un nuevo ciclo de oxidaciones en su carbono ß (otra "vuelta" de la hélice de Lynen), y así sucesivamente hasta la total degradación a acetil-CoA del ácido graso original.
En general, un ácido graso activado de n átomos de carbono dará lugar a n/2 moléculas de acetil-CoA. Para ello serán necesarias (n/2)-1 vueltas de la hélice de Lynen; esto de debe a que, tras la escisión de la última molécula de acetil-CoA, el "ácido graso activado" que queda es ya una molécula de acetil-CoA que no necesita sufrir un nuevo ciclo de oxidaciones. Por cada vuelta de la hélice de Lynen se consume una molécula de CoA y se obtiene un NADH y un FADH2.
A partir de este momento las rutas degradativas de los ácidos grasos convergen con las de los azúcares: el acetil-CoA obtenido en la ß-oxidación es degradado mediante el Ciclo de Krebs y los coenzimas reducidos que se obtienen en ambas rutas ceden sus electrones a la cadena respiratoria que los conduce hasta el oxígeno para formar agua; en el proceso se desprende energía que es recuperada en forma de ATP en la fosforilación oxidativa.
Si, al igual que hicimos para los azúcares, reunimos toda la información de que disponemos acerca de la degradación de los ácidos grasos, y obtenemos el balance energético de la misma, comprobaremos que se obtiene una cantidad de ATP proporcionalmente superior a la que se obtendría a partir de la degradación de azúcares de semejante peso molecular, lo cual está en concordancia con la afirmación de que las grasas poseen un contenido energético mayor que el de los azúcares. La razón de que ello sea así reside en que, por ser las grasas sustancias altamente hidrogenadas o reducidas, tienen un amplio margen de oxidación, es decir, poseen muchos electrones que pueden ceder a la cadena respiratoria durante este proceso, lo que se traduce en un mayor rendimiento energético en moléculas de ATP.
3.-CATABOLISMO DE PROTEÍNAS.
Por lo general las células no utilizan las proteínas como combustible metabólico más que en casos de extrema necesidad. Sin embargo, las células están renovando constantemente sus proteínas. Como parte de este proceso de renovación las proteínas son degradadas a aminoácidos por acción de unos enzimas llamados proteasas. Muchos aminoácidos resultantes de esta degradación son reutilizados para la síntesis de nuevas proteínas; otros, que en un momento dado pueden resultar sobrantes, deben a su vez ser degradados, ya que, a diferencia de lo que ocurre con azúcares y lípidos, no pueden ser almacenados en forma de sustancias de reserva.
La degradación de los aminoácidos se realiza en dos fases sucesivas: la separación de los grupos amino y la degradación de los esqueletos carbonados.
3.1.-SEPARACIÓN DE LOS GRUPOS AMINO.
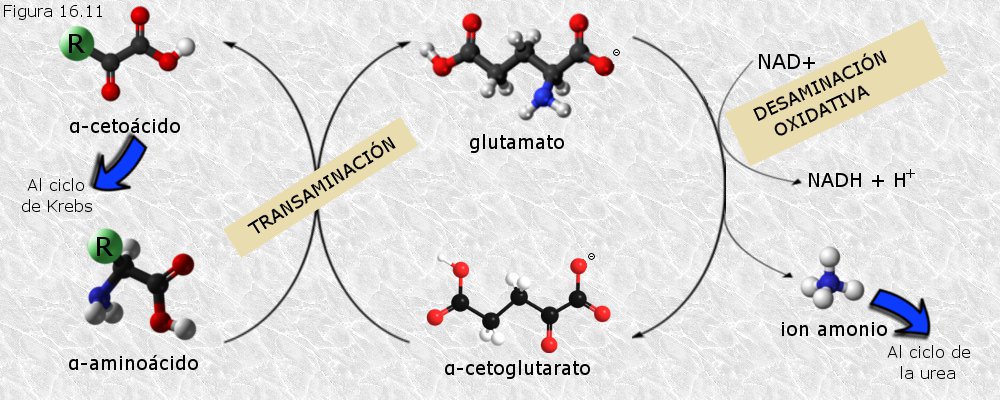
Tiene lugar en el hialoplasma y transcurre a su vez en dos fases (Figura 16.11):
a) Transaminación.- Los grupos amino de los diferentes aminoácidos son cedidos, mediante reacciones de transaminación catalizadas por las transaminasas, a un cetoácido, el ácido α-cetoglutárico, que se transforma entonces en ácido glutámico. El ácido glutámico funciona como una especie de colector de grupos amino. Lo que queda de un aminoácido tras ceder su grupo amino en la transaminación es lo que llamamos su esqueleto carbonado.
b) Desaminación oxidativa.- El ácido glutámico obtenido en la fase de transaminación sufre la pérdida de su grupo amino en forma de amoníaco y se recupera el ácido α-cetoglutárico. El proceso implica una oxidación que da lugar a NADH o NADPH.
El amoníaco procedente de la desaminación oxidativa es un producto final del catabolismo de los aminoácidos y debe ser excretado. En algunos animales, como los peces, el amoníaco puede ser excretado como tal a través de la piel. Sin embargo, para otros animales, como los mamíferos, este compuesto resulta altamente tóxico y puede causar graves daños en las células si llega a acumularse en su interior. Para evitar estos problemas los mamíferos transforman el amoníaco en otro compuesto menos tóxico, la urea, que se obtiene en un complejo ciclo de reacciones que tiene lugar en parte en el hialoplasma y en parte en la matriz mitocondrial y que se conoce como ciclo de la urea. Posteriormente la urea puede ser fácilmente excretada a través de la orina.
3.2.-DEGRADACIÓN DE LOS ESQUELETOS CARBONADOS.
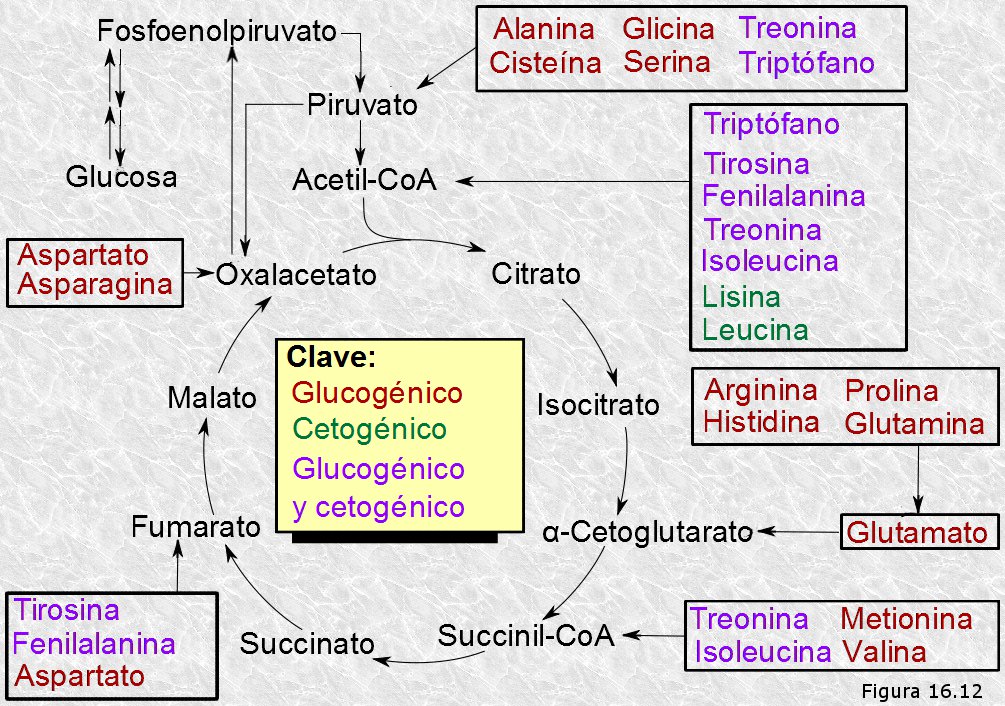
Los esqueletos carbonados de muchos aminoácidos coinciden con diversos intermediarios del ciclo de Krebs o rutas colindantes (ácido pirúvico, acetil-CoA, ácido cetoglutárico, ácido succínico, etc.), por lo tanto pueden penetrar en la matriz mitocondrial y ser degradados siguiendo estas rutas metabólicas centrales (Figura 16.12).
4.-CATABOLISMO DE LOS ÁCIDOS NUCLEICOS.
Al igual que sucedía con las proteínas, los ácidos nucleicos no son habitualmente utilizados como combustible metabólico. Los nucleótidos que resultan de la hidrólisis de los ácidos nucleicos por acción de las nucleasas son generalmente reciclados hacia la síntesis de nuevos ácidos nucleicos. Sin embargo, en caso de que existan nucleótidos sobrantes, éstos pueden ser degradados a sus componentes moleculares (pentosas, ácido fosfórico y bases nitrogenadas), los cuales a su vez pueden ser degradados de la siguiente manera:
a) Pentosas.- mediante la ruta de las pentosas.
b) Ácido fosfórico.- se excreta como tal por la orina
c) Bases nitrogenadas.- se degradan siguiendo complejas rutas que dan lugar a urea, amoníaco y ácido úrico.
5.-PANORÁMICA GENERAL DEL CATABOLISMO.
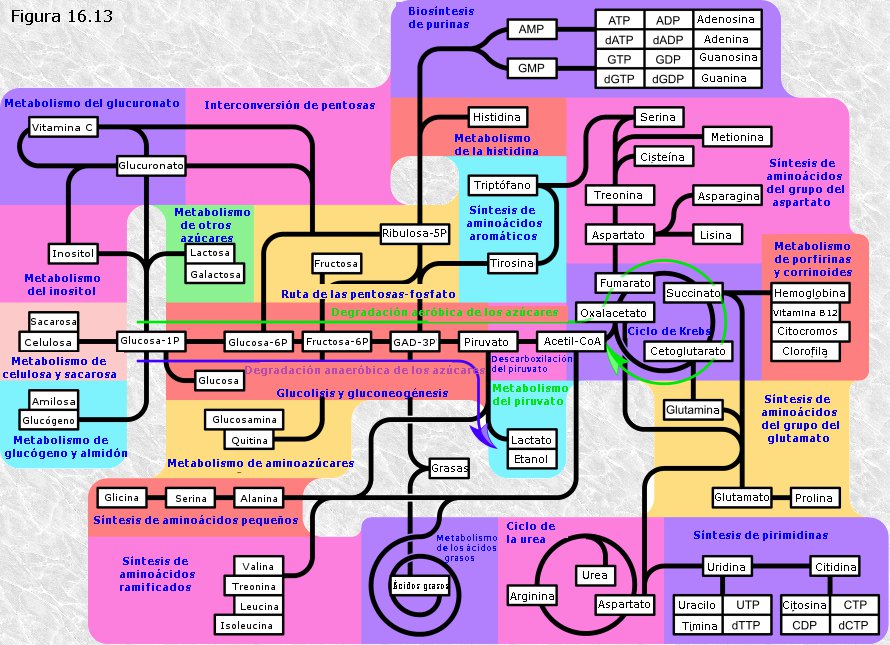
El análisis pormenorizado que hemos realizado acerca de las diferentes rutas catabólicas que conducen a la degradación de los diferentes tipos de biomoléculas no debe hacernos perder la perspectiva del catabolismo como una actividad altamente integrada, en la que dichas rutas convergen en su tramo final para dar lugar a unos pocos productos de deshecho (CO2, agua, amoníaco), compartiendo todas ellas el objetivo común de recuperar una parte de la energía química de las biomoléculas degradadas en forma de ATP. Una idea de conjunto acerca del funcionamiento integrado de las distintas rutas catabólicas, junto con las correspondientes rutas anabólicas, se podrá obtener de una inspección detenida de la Figura 16.13.