|
|
CURSO DE BIOLOGÍAAlejandro Porto Andión |
|
|
|
|
|
|
|
Inicio Aula virtual |
|
|
|
|
Respuestas a las preguntas breves
-
¿Por qué decimos que los niveles de organización atómico y molecular son niveles abióticos?
Porque las estructuras propias de estos niveles (átomos y moléculas) no están dotadas de los atributos de la vida.
-
¿Cuáles son los atributos que identifican a los seres vivos y los hacen diferentes de la materia inanimada?
· Complejidad.- Alto grado de organización
· Funcionalidad (o teleonomía).- Sus partes constituyentes cumplen propósitos o funciones específicas.
· Capacidad de nutrición.- Pueden manipular eficazmente la materia y la energía de su entorno para construir y mantener sus propias y complejas estructuras.
· Capacidad de relación.- Pueden percibir estímulos procedentes de su entorno y elaborar respuestas frente a ellos.
· Capacidad de reproducción.- Pueden dar lugar a otros seres vivos de características similares a ellos.
-
¿Qué caracteriza a cada nivel de organización en relación con los inferiores a él?
El hecho de en cada nivel aparece propiedades y procesos (emergentes) que no están presentes en niveles inferiores y que son un resultado del mayor grado de organización de la materia.
-
¿En qué se diferencian los bioelementos primarios y secundarios?
Los bioelementos primarios se encuentran formando parte de los principales tipos de biomoléculas orgánicas (basadas en el carbono), mientras que los bioelementos secundarios se encuentran formando parte de las biomoléculas inorgánicas
-
¿Qué significado puede tener la uniformidad en la composición elemental de la materia viva?
Es un hecho que apoya la idea de que todas las formas de vida tienen un origen común.
-
Explica la diferencia entre bioelemento secundario y oligoelemento.
Los oligoelementos son un tipo de bioelementos secundarios: aquellos que se encuentran e la materia viva en proporciones muy pequeñas.
-
¿Qué característica presentan en conjunto los bioelementos primarios que los hace idóneos para formar parte de las biomoléculas? ¿Y el carbono en particular?
Son elementos no metálicos de bajo número atómico con capacidad para formar entre ellos enlaces covalentes muy estables. El carbono, además, puede formar enlaces con otros átomos de carbono, lo que le permite dar lugar a una gran variedad de cadenas carbonadas (lineales, ramificadas, cíclicas), lo que está en la base de la enorme diversidad de formas moleculares que presenta la química orgánica. La posibilidad de que los enlaces entre átomos de carbono puedan ser dobles y triples multiplica estas posibilidades.
-
Explica por qué el silicio no puede dar lugar a una variedad de compuestos químicos tan grande como lo hace el carbono.
Aunque teóricamente se pueden formar enlaces Si-Si, lo que en principio haría suponer que el silicio puede dar lugar a una química tan variada como el carbono, lo cierto es que estos enlaces son muy inestables frente a los enlaces Si-H y, sobre todo, los enlaces Si-O, por lo que los enlaces Si-Si se romperían rápidamente e presencia de estos otros elementos.
-
¿A qué llamamos grupo funcional? ¿Cita y escribe la estructura química de los más relevantes entre las biomoléculas?
A un grupo de átomos enlazados de un modo característico, que dan al compuesto que los posee sus propiedades químicas características.
-
Pon algunos ejemplos de macromoléculas y cita los sillares estructurales de que están compuestas.
· Proteínas – aminoácidos
· Polisacáridos – monosacáridos
· Ácidos nucleicos - nucleótidos
-
¿Qué ventajas representan las interacciones débiles frente a los verdaderos enlaces químicos en los procesos biológicos?
Presentan la ventaja de ser fácilmente reversibles, por lo que pueden formarse y romperse con facilidad. Ello a su vez facilita las interacciones entre las distintas biomoléculas
-
Formula las líneas básicas de la hipótesis de Oparin. ¿Qué es lo que demostró Stanley Miller con su experimento sobre atmósferas simuladas?
Según Oparin, la atmósfera primitiva de la Tierra tenía carácter reductor (era rica en gases como vapor de agua, amoníaco, metano, hidrógeno, etc.) Las frecuentes descargas eléctricas de entonces habrían hecho reaccionar a estos gases para dar lugar a compuestos orgánicos sencillos en los que el océano primitivo se habría ido enriqueciendo. En esa “sopa primigenia” habría surgido espontáneamente las primeras células.
Miller demostró que, de ser correctas la suposiciones de Oparin acerca de la composición de la primitiva atmósfera, la síntesis de las primeras biomoléculas era posible.
-
¿Qué unidades utilizarías para expresar las dimensiones de las biomoléculas? ¿Cuál es su equivalencia en metros?
· Unidad para dimensiones de las biomoléculas.- 1 nm = 10-9 m
-
¿Qué tipo de modelo molecular construirías si quisieras representar una biomolécula de modo que se pudiesen apreciar los ángulos de enlace y las distancias entre átomos?
Un modelo de bolas y varillas.
-
¿Cómo variaría el punto de fusión del agua si el oxígeno no fuese un elemento tan electronegativo? Justifica la respuesta ¿Y si la geometría de sus orbitales de enlace fuese lineal y no tetraédrica?
Si el oxígeno no fuese tan electronegativo no atraería hacia sí con tanta intensidad a los electrones compartidos con los hidrógenos, por lo tanto, las cargas eléctricas parciales sobre la molécula de agua serían menores. La consecuencia sería que las interacciones electrostáticas (puentes de H) entre moléculas de agua vecinas serían menos intensas, con lo que el punto de fusión sería más bajo.
Si la geometría de la molécula fuese lineal, existirían cargas eléctricas parciales, pero estarían alineadas, de manera que el carácter dipolar de la molécula de agua sería menos acusado. Todo ello con las mismas consecuencias que en el caso anterior.
-
El metano (CH4) en estado líquido, ¿sería un buen disolvente de sustancias iónicas? Ten en cuenta que C y H tienen electronegatividades semejantes.
No lo sería, dado que al tener C y H electronegatividades similares, compartirán por igual los electrones de los enlaces y no aparecerán cargas parciales sobre la molécula. Así, las moléculas de metano no podrán interactuar con las sustancias iónicas y no podrán disolverlas.
-
¿A qué se debe el que el ángulo que forman los tres átomos de la molécula de agua sea algo menor de lo que cabría esperar de su geometría tetraédrica?
A que la repulsión electrostática mutua entre los lóbulos orbitales no enlazantes del oxígeno comprime ligeramente a los lóbulos orbitales que forman los enlaces con el hidrógeno y los obliga a acercarse.
-
Explica por qué el agua es un fluido tan poco viscoso a pesar de que sus moléculas están intensamente ligadas por puentes de hidrógeno.
Se debe a la corta vida del puente de hidrógeno. Estos puentes están formándose y rompiéndose continuamente a gran velocidad, por lo que las moléculas de agua disfrutan de una gran movilidad aunque en un instante dado estén muy ligadas a otras por puentes de H.
-
¿Qué condiciones se han de dar para que se forme un puente de hidrógeno entre dos moléculas cualesquiera?
Que exista un átomo de hidrógeno unido covalentemente a un átomo electronegativo y que ese hidrógeno esté enfrentado a otro átomo electronegativo de la otra molécula.
-
¿Qué característica común presentan los compuestos de carácter hidrofílico? ¿Y los de carácter hidrofóbico?
· Hidrofílico.- Presencia de cargas eléctricas (netas o parciales)
· Hidrofóbico.- Ausencia de cargas eléctricas.
-
Analiza brevemente el por qué las moléculas anfipáticas tienden a formar micelas y estructuras afines cuando se encuentran en medio acuoso.
Cuando se encuentran en medio acuoso, las dos zonas que presentan estas moléculas experimentan tendencias contrapuestas: las cabezas polares tienden a situarse en contacto con las moléculas de agua mientras que las colas no polares tienden a aislarse de ella. El resultado es la formación de micelas y estructuras afines, en las que tales condiciones se cumplen.
-
¿Cuál es la causa de que las disoluciones acuosas presenten propiedades coligativas que no aparecen en el agua pura?
Las interacciones con las moléculas o iones del soluto alteran la geometría característica de las agrupaciones de moléculas de agua, con lo que se alteran algunas de sus propiedades físicas.
-
Explica por qué las células vivas se ven afectadas por fenómenos osmóticos.
Porque la membrana celular es una membrana semipermeable, que deja pasar libremente a las moléculas de agua, pero restringe el paso de los distintos solutos disueltos en ella.
-
Define con precisión ósmosis y presión osmótica.
Ósmosis.- Flujo diferencial de disolvente que se produce entre dos disoluciones de diferente concentración separadas por una membrana semipermeable (membrana que deja pasar las moléculas del disolvente pero no las del soluto).
Presión osmótica.- presión hidrostática capaz de contrarrestar en el equilibrio el flujo diferencial de disolvente entre dos disoluciones de diferente concentración separadas por una membrana semipermeable.
-
¿En qué se diferencia una disolución coloidal de una disolución verdadera?
En el tamaño de las partículas del soluto: si el tamaño de partícula es menor que 10 nm se trata de una disolución verdadera; si es mayor que 10 nm se trata de una disolución coloidal.
-
¿Qué le ocurrirá a un glóbulo rojo si lo colocamos en un medio hipertónico? ¿Y en un medio hipotónico?
· Medio hipertónico.- el glóbulo perderá agua y sufrirá retracción
· Medio hipertónico.- entrará agua en el glóbulo y se producirá turgencia y eventualmente lisis celular.
-
Pon un ejemplo de un par ácido-básico conjugado.
· Ácido acético-acetato
· Ion amonio-amoníaco
· ……………
-
Define ácido y base según el concepto de Brönsted-Lowry.
Un ácido es una sustancia con tendencia a ceder iones hidrógeno
Una base es una sustancia con tendencia a captar iones hidrlogeno.
-
¿Por qué resulta útil la escala de pH?
Porque, por ser una escala logarítmica, permite expresar la concentración de iones H en disoluciones acuosas diluidas sin recurrir a números de difícil manejo (con muchas cifras decimales o potencias negativas de 10)
-
Relaciona la fuerza de los ácidos con la constante de disociación y el pK.
Los ácidos fuertes presentan constantes de disociación elevadas y valores de pK bajos. Los ácidos débiles al revés.
-
¿Qué expresión matemática describe la forma de las curvas de titulación de los pares ácido-básicos conjugados?
Ecuación de Henderson-Hasselbalch
-
¿Por qué en un sistema tampón deben existir cantidades aproximadamente iguales de las especies dadora y aceptora de protones?
Porque de este modo tales especies pueden ceder o captar protones según se añada a la disolución una base o un ácido, y así mantener el pH invariable
-
El ácido acético tiene un pK=4,76. ¿Cuáles serán aproximadamente los límites de sur región tamponante?
Entre 4,26 y 5,26
-
Explica por qué las células vivas necesitan tampones.
Porque muchas moléculas biológicamente importantes (en particular las proteínas) son muy sensibles a los cambios en el pH, pudiendo quedar inutilizadas si estos cambios se producen.
-
¿Por qué en los sistemas vivos las interacciones iónicas se consideran interacciones débiles y no verdaderos enlaces químicos?
Porque el agua, como indica su elevada constante dieléctrica, reduce considerablemente las fuerzas atractivas entre cargas eléctricas que se encuentran en su seno. Las interacciones iónicas en el seno de los sistemas acuosos tienen energías de enlace similares a las de otras interacciones débiles.
-
¿Cuál es el papel de las sales minerales disueltas en la materia viva?
· Precipitadas.- función estructural (huesos, conchas, caparazones)
· Disueltas.- regulación de fenómenos osmóticos, pH, etc.
-
¿Qué característica química común a todos los lípidos es la responsable de su escasa solubilidad en agua?
La estructura de la molécula es en su totalidad o al menos en parte de naturaleza hidrocarbonada.
-
¿Qué rasgo estructural común presentan los lípidos saponificables?
Presentan como parte de su molécula al menos un ácido graso unido mediante un enlace éster al resto de ella.
-
Define en pocas palabras lo que se entiende por ácido graso.
Compuesto orgánico que presenta un grupo funcional carboxilo y una cadena hidrocarbonada larga (entre 12 y 24 C en la mayoría de los casos).
-
Explica por qué las grasas ricas en ácidos grasos insaturados son líquidas a temperatura ambiente mientras que las ricas en ácidos grasos saturados son sólidas a esa temperatura.
El cambio de orientación que presenta la cadena hidrocarbonada de los ácidos grasos cis-insaturados impide que sus moléculas puedan establecer interacciones de Van der Waals con sus vecinas en toda su longitud (lo que sí ocurre en los saturados). Así, al haber menos de estas interacciones la energía requerida para romperlas al pasar del estado sólido al líquido es menor, con el consiguiente descenso del punto de fusión.
-
Explica cómo influye la longitud de la cadena hidrocarbonada en el punto de fusión de los ácidos grasos.
Cuanto más larga es la cadena hidrocarbonada más interacciones de Van der Waals podrá establecer cada molécula con sus vecinas. Por lo tanto, cuanto más larga es la cadena más energía habrá que emplear para romper dichas interacciones, con el consiguiente aumento del punto de fusión.
-
¿Qué ventajas e inconvenientes presentan los lípidos como material de reserva energética para los seres vivos?
Ventajas.- Por ser sustancias muy hidrogenadas son muy ricas en energía (tienen una densidad energética elevada) lo que permite almacenar en ellos mucha energía en una masa relativamente pequeña. Además, al ser sustancias hidrofóbicas se almacenan en forma anhidra (sin agua), por lo que su almacenamiento no conlleva el aumento de peso que supondría el agua de hidratación si fuesen hidrofílicos (como los polisacáridos).
Inconvenientes.- Su nula o escasa solubilidad en agua hace que sean de movilización muy lenta y difícil transporte, tanto en el interior de la célula como en el medio interno de los organismos pluricelulares. Ello hace que no puedan ser utilizados como fuente de energía ante una necesidad perentoria.
-
¿Cómo harías para obtener jabón a partir de la grasa de cerdo?
Mezclaría la grasa con sosa cáustica (NaOH) y la pondría a fuego lento durante varias horas removiendo frecuentemente. Se produciría una reacción de saponificación que rendiría por una parte glicerina, y por otra, sales sódicas de los ácidos grasos, es decir, jabones. Luego lo dejaría enfriar todo, con lo que se solidificaría. Lo cortaría en tacos listos para su uso.
-
¿Qué otras funciones desempeñan los triacilglicéridos en los seres vivos, además de la de reserva de energía?
Dado que conducen mal el calor, funcionan como aislante térmico en muchos animales (cetáceos, etc.).
También ejercen un papel de amortiguador mecánico en algunos animales.
-
Describe la estructura química de una cera.
Un cérido (o cera) es un éster de un ácido graso con un alcohol monohidroxílico de cadena larga (alcohol graso)
-
¿Por qué las cubiertas de algunos frutos están impregnadas en ceras?
Dado su carácter hidrofóbico, las ceras ejercen una función impermeabilizante en muchos seres vivos. En concreto en los frutos impiden la desecación por evaporación del agua que contienen.
-
¿Qué compuestos obtendríamos si rompemos mediante hidrólisis todos los enlaces éster de un fosfoglicérido?
Una molécula de glicerina.
Dos ácidos grasos.
Una molécula de ácido fosfórico.
Un compuesto polar (base nitrogenada, alcohol, aminoácido, etc.)
-
¿Qué propiedad de los fosfoglicéridos los faculta para formar parte de las membranas biológicas?
Su carácter anfipático. Además, al poseer dos colas hidrocarbonadas su molécula se inscribe en un cilindro (no en un cono como los ácidos grasos libres), lo que les impide formar micelas y favorece la formación de bicapas y liposomas.
-
¿Qué compuestos obtendríamos si rompemos mediante hidrólisis todos los enlaces éster y amida de un esfingfosfátido?
Esfingosina
Un ácido graso
Ácido fosfórico
Un compuesto polar (base nitrogenada, alcohol, aminoácido, etc.)
-
Explica por qué los ácidos grasos libres tienden a formar micelas en medio acuosos, mientras que los fosfoglicéridos tienden a formar bicapas y liposomas.
Al poseer dos colas hidrocarbonadas su molécula se inscribe en un cilindro (no en un cono como los ácidos grasos libres), lo que les impide formar micelas (las colas hidrocarbonadas no caben en el interior de la micela) y favorece la formación de bicapas y liposomas.
-
¿Qué compuesto resulta de la unión de una ceramida y una molécula de glucosa?
Un esfingolípido. Más concretamente, un glucoesfingolípido. Y más concretamente todavía, un cerebrósido (la glucosa es un azúcar simple).
-
¿Por qué los terpenos no son saponificables?
Porque no contienen ácidos grasos unidos mediante enlace éster a otra parte de su molécula.
-
Cita algunas funciones de los terpenos en los seres vivos. ¿En cuál de los reinos de los seres vivos se encuentran preferentemente?
Funcionan como pigmentos y aromas. Son precursores de vitaminas como la vitamina A. Se encuentran preferentemente en el reino vegetal.
-
¿Cuál es la principal función del colesterol en las células vivas?
Su carácter anfipático lo faculta para formar parte de las membranas biológicas, en las que contribuye a su fluidez.
-
Cita algunas biomoléculas de importancia biológica que derivan del colesterol.
· Hormonas sexuales (testosterona, estrógenos, progesterona)
· Hormonas adrenocorticales (aldosterona, cortisol)
· Sales biliares
· Vitamina D
-
¿En qué grupo de lípidos clasificarías a las prostaglandinas? Justifica la respuesta.
Son icosanoides. Resultan de la ciclación del ácido araquidónico (20 C)
-
¿Por qué los glúcidos fueron denominados hidratos de carbono?
Porque la fórmula empírica que comparten muchos de ellos, (CH2O)n, sugiere que consisten en algún tipo de combinación de carbono (C) y agua (H2O), de ahí la expresión “hidratos de carbono”. Esta denominación es químicamente incorrecta, pues los glúcidos no consisten en combinaciones de carbono y agua sino en unidades de polihidroxialdehidos o polihidroxicetonas. Sin embargo su uso está muy extendido.
-
Describe la estructura básica de un monosacárido.
Un monosacárido consiste en una cadena carbonada no ramificada de 3 a 8 carbonos, en la que todos los carbonos llevan unido un grupo hidroxilo excepto uno que forma parte de un grupo carbonilo (aldehído o cetona).
-
¿Qué compuestos se obtienen cuando se somete a un ósido a hidrólisis completa?
Los compuestos obtenidos son monosacáridos (también llamados osas).
-
Escribe la fórmula de una cetotetrosa y una aldopentosa en forma de cadena abierta.
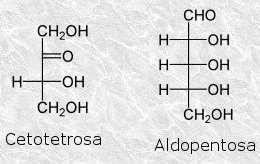
-
¿Cuántos estereoisómeros presenta una cetopentosa? ¿Y una aldohexosa en forma de cadena abierta?
· Cetopentosa.- presenta 2 carbonos asimétricos (el 3’ y el 4’). Luego presentará 22= 4 estereoisómeros.
· Adohexosa (cadena abierta).- presenta 4 carbonos asimétricos (el 2’, el 3’, el 4’ y el 5’). Luego presentará 24= 16 estereoisómeros.
Nota aclaratoria.- Para determinar el número de carbonos asimétricos se puede escribir la fórmula (proyección de Fisher) del monosacárido y contarlos directamente, o bien aplicar las reglas estudiadas (x-2 para las aldosas y x-3 para las cetosas).
-
Distingue entre: estereoisómero, enantiómero, epímero, anómero.
· Estereoisómero.- Llamamos así a cualquiera de las formas isómeras que presenta un compuesto quiral debido a la presencia de átomos de carbonos asimétricos. Por ejemplo, las aldohexosas presentan 16 formas estereisómeras en función de la configuración de sus diferentes átomos de carbono asimétricos.
· Enantiómero.- Cuando dos estereiosómeros son además imágenes especulares no superponibles uno del otro, decimos que son enantiómeros. Por ejemplo, la D-glucosa y la L-glucosa son enantiómeros
· Epímeros.- Cuando dos estereisómeros difieren solamente en la configuración de uno de sus átomos de carbono asimétricos, decimos que son epímeros.
· Anómeros.- Reservamos esta denominación para hacer referencia a las formas estereoisómeras de los monosacáridos que aparecen como consecuencia de la formación de los anillos de piranosa o furanosa. Cuando los monosacáridos se ciclan, el átomo de carbono del grupo carbonilo, que no es asimétrico en la forma de cadena abierta, se convierte en asimétrico, con la consiguiente aparición de dos nuevas formas estereoisómeras (formas anoméricas o anómeros), que difieren en la configuración de este nevo átomo de carbono asimétrico (carbono anomérico). Por ejemplo, la α-D-glucosa y la β-D-glucosa, son formas anoméricas.
-
Enuncia el criterio para asignar a un monosacárido a la serie D o a la serie L. ¿Qué relación tiene la pertenencia a serie D o serie L con el fenómeno de la rotación óptica?
En la fórmula en proyección de Fisher, se ha de comprobar la posición del grupo hidroxilo del átomo de carbono asimétrico más alejado del átomo de carbono carbonílico. Si está hacia la derecha el monosacárido pertenece a la serie D, y si está hacia la izquierda pertenece a la serie L.
La rotación óptica de un monosacárido es independiente de pertenencia a la serie D o a la serie L
-
¿A qué llamamos rotación óptica?
Al ángulo en que resulta rotado el plano de vibración de la luz polarizada al atravesar una disolución de una sustancia ópticamente activa.
-
Escribe la fórmula de una aldohexosa en forma de cadena abierta y en forma de anillo de piranosa. Señala en esta última el carbono anomérico.
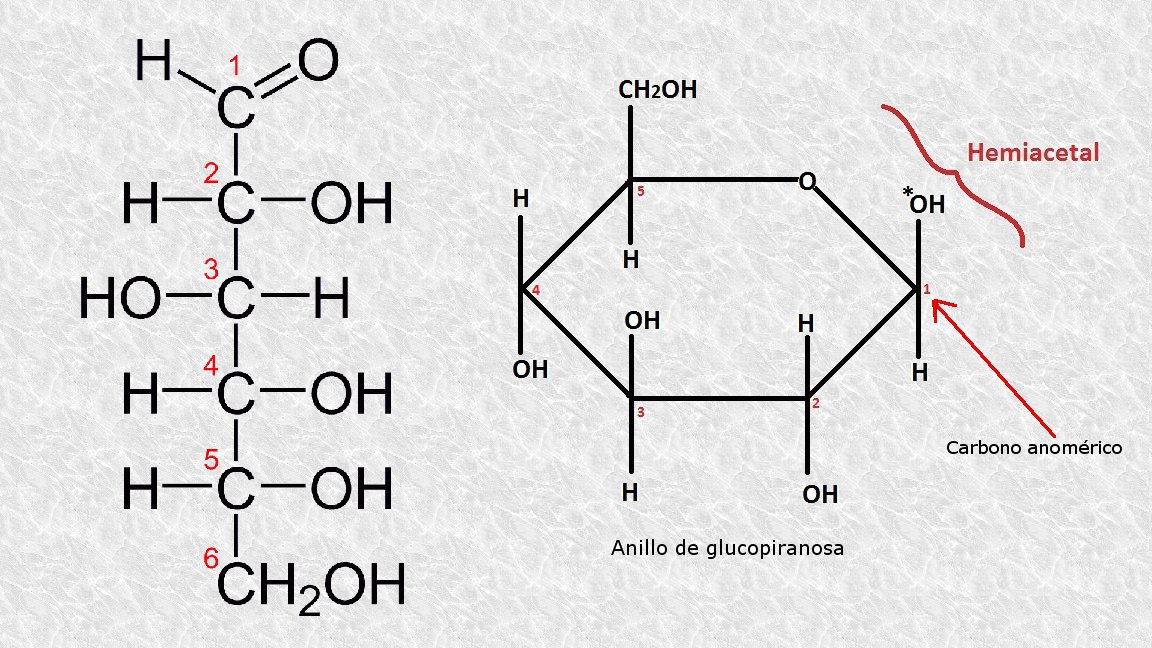
-
¿Por qué las disoluciones de D-glucosa presentan el fenómeno de la mutarrotación?
Las disoluciones de D-glucosa presentan rotaciones ópticas diferentes según el monosacárido que se disuelve sea α-D-glucosa o β-D-glucosa. Pasados unos minutos desde que se prepara la disolución, con independencia de que se haya partido de uno u otro anómero de la glucosa, ambas formas se interconvierten (pasando por la forma de cadena abierta) hasta que se alcanza un equilibrio en el que están presentes 1/3 de α-D-glucosa y 2/3 de β-D-glucosa. Esta mezcla exhibe una rotación óptica diferente a la que inicialmente exhibían una y otra forma anomérica. El cambio observado en la rotación óptica entre el instante inicial y el momento en que se alcanza el equilibrio recibe el nombre de mutarrotación.
-
¿Por qué la glucosa no exhibe las propiedades químicas que cabría esperar de un polihidroxialdehido?
Porque frecuentemente se encuentra en forma cíclica (anillo de piranosa) Las formas cíclicas de los monosacáridos resultan de una reacción intramolecular en la que se forma un hemiacetal (o hemicetal) al reaccionar el grupo carbonilo con uno de los grupos hidroxilo. Así, estos monosacáridos no se comportan como aldehídos (o cetonas), porque sus grupos carbonilo no se encuentran libres, sino que han reaccionado con un grupo hidroxilo para fomar el anillo. En realidad ya no son aldehídos (o cetonas) sino hemiacetales (o hemicetales).
-
¿Qué utilidad presentan las proyecciones de Haworth de la que carecen las de Fisher?
Que permiten representar las formas cíclilcas de los monosacáridos.
-
Explica por qué unos monosacáridos dan lugar a formas cíclicas y otros no lo hacen.
Para que tenga lugar la formación de un hemiacetal (o hemicetal) intramolecular, con la consiguiente formación de un anillo de piranosa o furanosa, los grupos funcionales implicados deben poder acercarse lo suficiente como para que la reacción pueda tener lugar. Esto no ocurre si la cadena carbonada del monosacárido no es suficientemente larga. Por ello, los monosacáridos de menos de 5 carbonos no pueden dar lugar a formas cíclicas (y los de 5 carbonos sólo si se trata de aldosas).
-
Explica por qué los monosacáridos de 3 y 4 átomos de carbono no forman enlaces glucosídicos.
El enlace glucosídico es un caso particular de la reacción de un hemiacetal (o hemicetal) con un alcohol para dar un acetal (o cetal). Por lo tanto, para que dos monosacáridos puedan unirse mediante enlace glucosídico, al menos uno uno de ellos tiene que encontrarse en forma cíclica, es decir, en forma de hemiacetal (o hemicetal) intramolecular. Los monosacáridos de 3 y 4 carbonos no pueden dar lugar a formas cíclicas por que en ellos los grupos funcionales que deben reaccionar no pueden acercarse lo suficiente, y por ello no pueden formar enlaces glucosídicos.
-
¿Por qué algunos disacáridos tienen poder reductor y otros no lo tienen? ¿Tienen poder reductor todos los monosacáridos? ¿Por qué?
Para que se conserve el poder reductor el azúcar debe conservar algún carbono carbonílico no implicado en un enlace glucosídico. Esto sucede en los disacáridos cuando el enlace es monocarbonílico (un solo carbono carbonílico implicado), por lo que estos disacáridos conservan el poder reductor; por el contrario, en los disacáridos con enlace dicarbonílico, los carbonos carbonílicos de los dos monosacáridos están implicados en el enlace glucosídico, con lo que se pierde el poder reductor.
Los monosacáridos siempren conservan un carbono carbonílico libre (no implicado en un enlace glucosídico), por lo que todos conservan el poder resductor.
-
¿Puede existir un homopolisacárido formado por unidades monoméricas de D-gliceraldehido? ¿Por qué?
El gliceraldehido es una aldotriosa. Los monosacáridos de 3 y 4 carbonos no pueden dar lugar a formas cíclicas por que en ellos los grupos funcionales que deben reaccionar no pueden acercarse lo suficiente. Por ello, el D-gliceraldehido no pueden formar enlaces glucosídicos, lo que le impide participar en la formación de todo tipo de ósidos, incluidos los polisacáridos.
-
¿Qué factor limita la posibilidad de los monosacáridos de dar lugar a formas cíclicas?
La longitud de su cadena carbonada. Si es demasiado corta impide el acercamiento de los grupos funcionales que deben reaccionar para dar lugar a la forma cíclica.
-
Cita cuatro tipos de derivados de los monosacáridos de importancia biológica.
Aminoazúcares, desoxiazúcares, azúcares ácidos, azúcares-alcoholes.
-
Relaciona el tipo de enlace glucosídico (α o β) presente en los polisacáridos con la función que éstos desempeñan en la naturaleza.
Los polisacáridos con enlace glucosídico tipo α tienen función energética (como el almidón o el glucógeno) mientras que los que los tienen tipo β tienen función estructural (como la celulosa o la quitina)
-
Dos monosacáridos se encuentran unidos mediante un enlace β(1→4). Explica el significado de esta notación.
El monosacárido que aporta al enlace glucosídico su átomo de carbono carbonílico se encuentra en su forma anomérica β. Este átomo de carbono carbonílico es el carbono 1 (se trata de una aldosa). El otro monosacárido aporta al enlace el grupo hidroxilo de su carbono 4.
-
¿Por qué los polisacáridos son insolubles en agua a pesar de ser sustancias altamente hidrofílicas?
Debido a su elevado peso molecular, que les impide mantenerse en disolución. Actúan más bien como “esponjas”, que absorben gran cantidad de agua, cuyas moléculas interactúan con los numerosos grupos hidroxilo del polisacárido.
-
¿Qué diferencia estructural hay entre el glucógeno y la amilopectina?
Ambos están formado por moléculas de glucosa unidas mediante enlaces glucosídico α(1à4) y con ramificaciones en forma de enlaces α(1à6). La diferencia está en el grado de ramificación. En el glucógeno las ramificaciones se encuentran más próximas entre sí que en la amilopectina.
-
¿Qué diferencia estructural hay entre el almidón y la celulosa?
En el almidón los enlaces glucosídicos son tipo α, mientras que en la celulosa son tipo β.
-
¿Qué ventajas y qué inconvenientes presentan los polisacáridos como material de reserva energética?
· Ventajas.- La movilización de esta reserva energética es rápida, pues de la hidrólisis de los polisacáridos resultan monosacáridos, que son solubles y por ello fácilmente transportables en medio acuoso.
· Inconvenientes.- Menor densidad energética que los lípidos. Implican un aumento de peso considerable para el organismo que los almacena, ya que a su mayor densidad, en comparación con los lípidos, se une el hecho de que retienen gran cantidad de agua debido a su carácter hidrofílico.
-
¿A qué se debe la extraordinaria resistencia mecánica de la celulosa? ¿Por qué otros polisacáridos importantes no presentan esta propiedad?
A la configuración espacial del enlace glucosídico tipo β, que da lugar a cadenas muy extendidas y que permite la formación de puentes de hidrógeno entre restos de glucosa de la misma cadena y de cadenas vecinas.
Los polisacáridos con enlaces tipo α no exhiben tal resistencia mecánica ya que el enlace glucosídico tipo α da lugar a cadenas de forma helicoidal que se estiran fácilmente a modo de muelles.
-
Dí qué tipos de compuestos se obtienen en cada caso tras someter a hidrólisis completa a los siguientes glúcidos: un homopolisacárido, un heteropolisacárido, un holósido, un heterósido.
· Homopolisacárido.- Monosacáridos, todos ellos iguales (ej. Glucosa)
· Heteropolisacáridos.- Monosacáridos de dos o más tipos.
· Holósido.-Exclusivamente monosacáridos.
· Heterósidos.- Monosacáridos y otros componentes no glucídicos.
-
¿Conoces algún lípido que pueda ser clasificado también como heterósido?
Los glucoesfingolípidos, que tienen una parte glucídica y otra no glucídica (la ceramida).
-
¿Por qué los monosacáridos son netamente solubles en agua?
Porque lo diferentes grupos hidroxilo que presentan pueden establecer puentes de hidrógeno con las moléculas de agua.
-
¿Qué bioelementos se encuentran presentes siempre en las proteínas y sólo ocasionalmente en los azúcares y los lípidos?
Nitrógeno y, en menor medida, azufre
-
A diferencia de lo que ocurre con otras macromoléculas como los polisacáridos, las cadenas de aminoácidos de las proteínas nunca son ramificadas. ¿Crees que sería posible sintetizar artificialmente una cadena polipeptídica ramificada? Justifica la respuesta.
No sería posible, ya que cada aminoácido tiene sólo dos grupos funcionales (amino y carboxilo) capaces de formar enlaces peptídicos. Es decir, cada aminoácido sólo se puede unir a otros dos, y no a tres, como exigiría la presencia de un punto de ramificación.
-
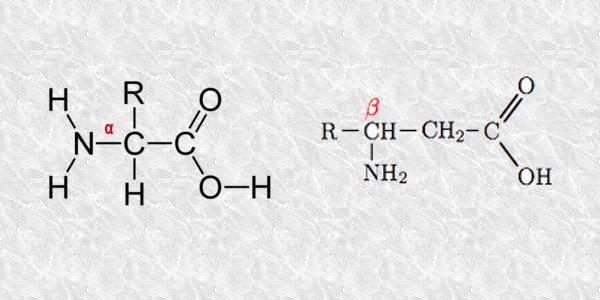
Escribe las fórmulas de un α y un β-aminoácido (utiliza el símbolo “R” para la cadena lateral). ¿Qué tipo de aminoácidos se hallan presentes en las proteínas?
-
Explica por qué los aminoácidos son sólidos cristalinos y tienen un punto de fusión más alto de lo que cabría esperar dada su estructura química.
Los aminoácidos se encuentran en disolución, y cristalizan a partir de las disoluciones, en forma de iones dipolares (con una carga negativa sobre el grupo carboxilo y una positiva sobre el grupo amino). En estado cristalino estos iones dipolares se mantienen unidos entre sí mediante enlaces iónicos (más fuertes que los puentes de hidrógeno o la fuerzas de Van der Waals), y son tales enlaces iónicos los que es necesario romper para pasar del estado sólido al líquido
-
Explica por qué los aminoácidos son más solubles en agua de lo que cabría esperar de su estructura química y de su relativamente elevada masa molecular.
Los aminoácidos se encuentran en disolución, y cristalizan a partir de las disoluciones, en forma de iones dipolares (con una carga negativa sobre el grupo carboxilo y una positiva sobre el grupo amino). Estos iones dipolares interactúan electrostáticamente con las moléculas de agua, lo que explica su alta solubilidad en ella
-
¿Qué carga neta presentará un aminoácido con grupo R no ionizable a pH isoeléctrico? ¿Y a pH 0? ¿Y a pH 14? (El pK del grupo carboxilo es de alrededor de 2 y el del grupo amino de alrededor de 10).
A pH isoeléctrico presentan carga neta 0 (por definición).
A pH 0 los grupos carboxilo habrán captado protones, desapareciendo así su carga negativa, por lo que presentarán una carga neta positiva (la del grupo amino).
A pH 14 los grupos amino habrán cedido sus protones, desapareciendo así su carga positiva, por lo que presentarán una carga neta negativa (la del grupo carboxilo).
-
¿Existen en la naturaleza D-aminoácidos? ¿Se encuentran formando parte de las proteínas?
Sí, existen algunos de ellos, pero no están formando parte de las proteínas, sino cumpliendo otras funciones biológicas.
-
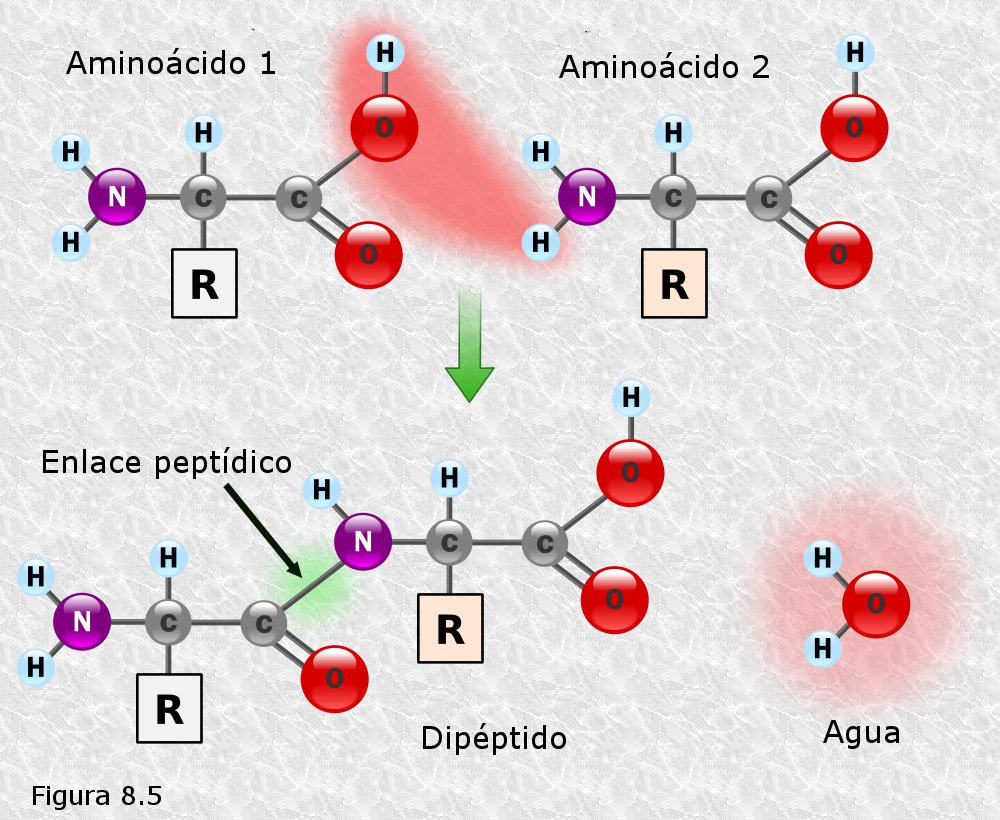
Escribe las fórmulas de dos aminoácidos cualesquiera y la reacción de formación de un enlace peptídico entre ellos.
-
¿Qué restricciones existen para la libertad de giro de los enlaces que forman el esqueleto de una cadena polipeptídica?
La principal reside en que el enlace peptídico, por tener un carácter parcial de doble enlace que impide que los sustituyentes de los átomos a ambos lados del enlace puedan girar con libertad.
-
¿Por qué el enlace peptídico no tiene libertad de giro?
Por su carácter parcial de doble enlace.
-
¿Qué relación existe entre las secuencias de aminoácidos de proteínas homólogas en especies diferentes?
Las secuencias de aminoácidos de proteínas homólogas en especies diferentes presentan grandes similitudes, lo que apoya la idea de una relación entre estructura proteica y función biológica.
-
Explica como se comportarán en medio acuoso las siguientes biomoléculas: un fosfoglicérido, un aminoácido, una cera, un disacárido, un triacilglicérido, un dipéptido, un ácido graso.
Fosfoglicérido.- Por su carácter anfipático formará estructuras del tipo de las micelas, bicapas y liposomas (preferentemente estas dos últimas debido a su forma cilíndrica).
Aminoácido.- Por ser una sustancia iónica (ion dipolar) resultará netamente soluble en agua.
Cera.- Por su carácter hidrofóbico resultará totalmente insoluble en agua.
Un disacárido.- Por su carácter polar (debido a los numerosos grupos OH que presenta), será netamente soluble en agua.
Un triacilglicérido.- Por su carácter hidrofóbico resultará totalmente insoluble en agua.
Un dipéptido.- Por ser una sustancia iónica (ion dipolar) resultará netamente soluble en agua.
Un ácido graso.- Por su carácter anfipático y gracias a su forma cónica formará estructuras del tipo de las micelas.
-
¿Podría cualquier secuencia de aminoácidos adoptar una estructura secundaria en hélice α? Justifica la respuesta.
El plegamiento en forma de hélice α obliga a los grupos R de los distintos aminoácidos a aproximarse entre sí, por lo que cabe esperar que aminoácidos con grupos R voluminosos o con cargas eléctricas no podrán adoptar esta estructura.
-
Un poliaminoácido sintético formado exclusivamente por restos de triptófano ¿adoptará espontáneamente una estructura secundaria en hélice α o preferirá la conformación β? Razona la respuesta. ¿Qué ocurrirá si el poliaminoácido está formado por restos de alanina? (Consulta la Tabla 8.1).
El triptófano es un amonácido con grupo R muy voluminoso, por lo que cabe esperar que inestabilice la hélice α. Es probable que este aminoácido tienda a adoptar una conformación β, que es más extendida que la hélice α
-
Define los términos estructura supersecundaria y dominio.
La estructura supersecundaria está formada por agrupamientos estables de estructuras secundarias que dan lugar a motivos estructurales que se repiten en multitud de proteínas diferentes.
Los dominios son regiones globulares densamente empaquetadas que se hallan conectadas entre sí por un corto tramo de cadena polipeptídica extendida o plegada en hélice α.
-
¿Qué tipos de interacciones débiles estabilizan la estructura terciaria de las proteínas?
Puentes de hidrógeno, interacciones iónicas, interacciones hidrofóbicas y fuerzas de Van der Waals.
-
¿Conoces algún tipo de enlace covalente, además del enlace peptídico, que pueda unir restos de aminoácidos en una cadena polipeptídica?
El puente disulfuro entre restos de cisteína.
-
¿En dónde se halla presente la estructura secundaria que denominamos codo β?
En lugares donde la cadena polipeptídica cambia abruptamente de dirección.
-
¿Cómo afectará una alteración en el pH de la disolución a una proteína cuya estructura terciaria se encuentra estabilizada por interacciones iónicas entre grupos R de diferentes aminoácidos?
La alteración del pH afectará al grado de ionización de esos grupos R, lo que puede suponer la desaparición de algunas cargas eléctricas implicadas en esas interacciones, que también desaparecerán, con la consiguiente desnaturalización de la proteína.
-
¿Por qué decimos que las interacciones débiles que estabilizan la estructura terciaria de las proteínas son interacciones de “largo alcance”?
Porque afectan a grupos R que pueden encontrarse muy alejados en la cadena polipeptídica pero que se encuentran próximos entre sí como consecuencia del plegamiento de la cadena.
-
¿Por qué las proteínas pierden su función biológica cuando se desnaturalizan?
Porque la desnaturalización implica la desaparición del centro activo a través del cual la proteína interactúa con su ligando.
-
¿Cuáles son las interacciones y enlaces que se rompen y cuáles las que no lo hacen durante el proceso de desnaturalización de una proteína?
Se rompen las interacciones débiles que estabilizan la conformación tridimensional, mientras que se mantienen los enlaces peptídicos entre los aminoácidos.
-
¿Por qué una proteína puede recuperar en determinadas condiciones su conformación tridimensional nativa después de haber sido desnaturalizada?
Porque la secuencia de aminoácidos contiene la información necesaria para especificar la conformación tridimensional nativa.
-
¿Por qué decimos que entre una proteína y su ligando específico hay una complementariedad estructural?
Porque la proteína y el ligando presentan superficies complementarias, que propician el acoplamiento entre ambos. Esta complementariedad es espacial y también química.
-
¿Qué compuestos obtendríamos si sometemos a un ácido nucleico a hidrólisis en condiciones suaves? ¿Y si lo hacemos en condiciones más drásticas?
· En condiciones suaves obtendríamos nucleótidos.
· En condiciones más drásticas obtendríamos una mezcla de pentosas, ácido fosfórico y bases nitrogenadas, es decir, los componentes de los nucleótidos.
-
¿Podrían formarse nucleósidos en los que la unión entre la base nitrogenada y la pentosa se estableciese a través del carbono 2' de ésta última? Razona la respuesta.
No, porque el enlace glucosídico requiere la participación del átomo de carbono carbonílico de la pentosa, y éste es el 1’ tanto en la ribosa como en la desoxirribosa.
-
¿A qué deben los ácidos nucleicos su carácter ácido?
A la presencia del ácido fosfórico entre sus componentes.
-
Describe la estructura de un nucleótido, mediante qué tipos de enlace están unidos sus componentes y cuáles son los átomos implicados en dichos enlaces.
Un nucleótido contiene una pentosa (que puede ser ribosa o desoxirribosa), una molécula de ácido fosfórico y una base nitrogenada. La pentosa y la base se unen mediante enlace N-glucosídico entre el carbono 1’ de la pentosa y el nitrógeno de la posición 1 de la base si ésta es pirimídica, o de la posición 9 si es púrica). El grupo fosfato se une mediante enlace éster con el carbono 5’ de la pentosa.
-
Nombra los componentes moleculares de los siguientes nucleótidos: AMP, CTP, dTDP, GMP, UTP.
· AMP.- Monofosfato de adenosina
· CTP.- Trifosfato de citidina.
· dTDP.- Difosfato de desoxitimidina.
· GMP.- Monofosfato de guanosina.
· UTP.- Trifosfato de uridina.
-
Asigna su nombre sistemático a cada uno de los siguientes nucleósidos:
-Nucleósido de adenina y ribosa.
-Nucleósido de timina y desoxirribosa.
-Nucleósido de guanina y desoxirribosa.
-Nucleósido de uracilo y ribosa.
-Nucleósido de citosina y ribosa.
-Nucleósido de adenina y ribosa. Adenosina
-Nucleósido de timina y desoxirribosa. Desoxitimidina
-Nucleósido de guanina y desoxirribosa. Desoxiguanosina
-Nucleósido de uracilo y ribosa. Uridina
-Nucleósido de citosina y ribosa. Citidina
-
Asigna su nombre sistemático a los nucleótidos formados por:
-Adenina, desoxirribosa y un grupo fosfato.
-Uracilo, ribosa y tres grupos fosfato.
-Timina, desoxirribosa y un grupo fosfato.
-Guanina, ribosa y tres grupos fosfato.
-Citosina, desoxirribosa y dos grupos fosfato.
-Adenina, desoxirribosa y un grupo fosfato. dAMP
-Uracilo, ribosa y tres grupos fosfato. UTP
-Timina, desoxirribosa y un grupo fosfato. dTMP
-Guanina, ribosa y tres grupos fosfato. GTP
-Citosina, desoxirribosa y dos grupos fosfato. dCDP
-
¿Qué otras funciones pueden desempeñar los nucleótidos en la célula además de ser los sillares estructurales de los ácidos nucleicos?
· Transpostadores de energía
· Coenzimas transportadores de electrones.
· Mensajeros intracelulares en la acción hormonal.
-
Establece una analogía entre la estructura primaria de las proteínas y la de los ácidos nucleicos.
El esqueleto de una cadena polipeptídicas es una sucesión monótona en la que se repite una secuencia simple de tres enlaces (C carboxílico, N amino, C alfa). De este esqueleto monótono se proyectan lateralmente los grupos R de los distintos aminoácidos de la cadena. Análogamente, en una cadena polinucleotídica el esqueleto es una sucesión monótona en la que simplemente se alternan pentosas y grupos fosfato. De este esqueleto monótono se proyectan lateralmente las diferentes bases nitrogenadas.
-
¿A qué llamamos extremo 5' y extremo 3' de una cadena polinucleotídica?
El extremo 5’ consiste en un grupo fosfato unido al carbono 5’ de la pentosa de un nucleótido. El extremo 3’ consiste en un grupo hidroxilo libre unido al carbono 3’ de la pentosa.